환경상식
산성비
산성비
자연상태의 빗물의 산성비 농도(pH)를 조사해 보면 5.6정도로 약한 산성을 나타냅니다. 이것은 공기중에 있는 이산화탄소가 빗물에 녹아 산성을 나타내기 때문입니다. 따라서 산성비는 pH 5.6이하의 비를 말합니다.
물론 대기중 빗물의 pH에 영향을 줄수 있는 요인은 이산화탄소 뿐만 아니라 다른 요소들도 많이 존재하는데, 토양 성분이 대기중에 많이 포함되어있는 지역에서는 토양중의 알칼리 금속, 알칼리 토금속이 녹아 염기성을 나타내기 때문에 빗물의 pH가 증가하기도 합니다.
오염원
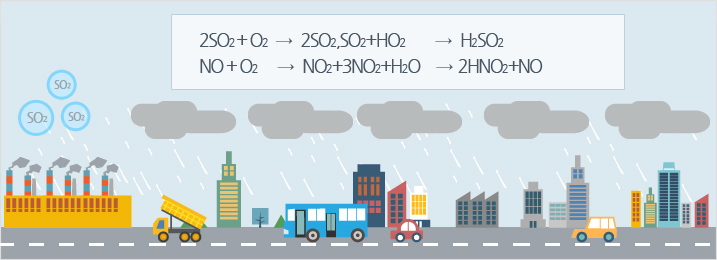
- 고정발생원에 의한 오염
공장, 화력발전소 또는 사업장이나 건물 및 가정에 설치되어 있는 보일러, 소각로, 가열로 등 고정배출시설에서 발생하는 황산화물, 질소산화물, 염소가스 등에 의한 오염으로 가장 주요한 오염원임 - 이동발생원에 의한 오염
자동차, 항공기, 기차 등의 이동배출시설에서 배출되는 황산화물, 질소산화물, 탄화수소 등 에 의한 오염원임.
산성비의 피해
산성비는 대기중의 오염물질, 황산과 질산을 포함하는데 이들은 식물체의 잎에 부착해 흡수되거나 씻겨 내려가며, 식물체의 잎에 흡수될 경우 산이 가지고 있는 탈수성과 반응성에 의해 잎이 부식되는데 그 결과 식물의 잎이 하얗게 되고 구멍이 생기고 엽록소가 파괴되어 잎이 누렇게 되어 조기 탈락하는 현상이 일어나게 됩니다.
즉, 질산염이 잎에 흡수되면 잎속의 K+ 와 H+ 이온이 질산염과 치환되어 잎속의 양분을 용탈시키고 식물체잎의 양분이 줄어 들면서 식물병과 해충에 대한 저항성이 작아져 나무나 식물체가 쉽게 병들고 죽게됩니다.
담당부서
- 환경사업소 기후환경과 환경정책팀
- 055-639-3941
최종수정일 : 2020-01-10
